Infuzní terapie
Prim. MUDr. Marek Hakl, Ph. D.
Koncept fixních kombinovaných analgetických přípravků je využíván zejména v oblasti perorální léčby bolesti. Fixní kombinace analgetických přípravků pro parenterální podání jsou v dnešní klinické praxi zastoupeny podstatně méně. V některých oborech se lze stále ještě setkat se směsnými infuzemi různého složení, připravovanými v lékárnách nebo na odděleních nemocnic. Klíčovým předpokladem vzájemné analgetické potenciace jsou odlišné mechanismy působení zastoupených účinných látek bez vzájemné antagonizace, u kterých lze také očekávat, že nebude docházet k adici, či dokonce potenciaci nežádoucích účinků. Nemalou roli hraje délka účinku takové kombinace, která by pochopitelně u všech jednotlivých složek měla být co nejpodobnější. V případě hromadně vyráběných fixních kombinací léčivých látek ve vhodných lékových formách jsou tyto vlastnosti zajištěny a ověřeny, stejně jako je ověřena kompatibilita a stabilita směsi účinných látek. Současně je u nich eliminována možnost chyby při přípravě a zajištěna standardní kvalita.
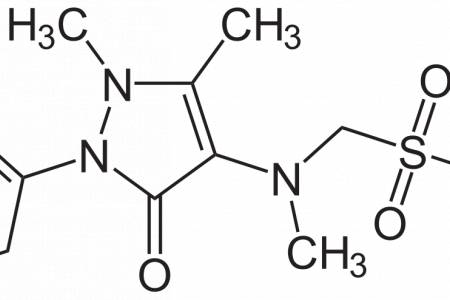
Neodolpasse® (Fresenius Kabi Austria GmbH) je fixní kombinovaný přípravek určený k intravenózní léčbě bolesti. Obsahuje diklofenak – nesteroidní antiflogistikum v dávce 75 mg a orfenadrin – vysoce účinné centrální myorelaxans, které působí preferenčně na příčně pruhované svalstvo se zvýšeným patologickým tonem, v dávce 30 mg. Dostupný je v balení 250 ml. Tato kombinace je u nás s velkým úspěchem používána již řadu let, přesto její farmakologické vlastnosti nejsou stále v odborné veřejnosti dostatečně dobře známy, což se týká především orfenadrinu. Je to právě jeho přítomnost v kombinaci, která je spolu s lékovou formou zodpovědná za jeho unikátní postavení ve spektru neopioidních analgetik.
Diklofenak byl syntetizován Alfredem Sallmannem a Rudolfem Pfisterem a v roce 1973 byl zaveden do klinické praxe. Od té doby se díky své velmi dobré účinnosti a bezpečnosti stal jednou z nejoblíbenějších a nejrozšířenějších látek ze skupiny nesteroidních antiflogistik.
Orfenadrin byl vyvinut jako parasympatolytikum a antihistaminikum již na konci 40. let 20. století profesorem Georgem Rieveschlem při vývoji derivátů antihistaminika difenhydraminu v laboratořích firmy Parke-Davis. Až do konce 60. let byl běžně používán v léčbě Parkinsonovy choroby, poté byl v této indikaci nahrazen modernějšími a především selektivnějšími léky. Nicméně jeho další postupně objevené a popsané účinky vedly k jeho využití jako centrálního myorelaxancia.
Kombinace orfenadrinu s neopioidním analgetikem pro injekční aplikaci byla poprvé registrována v Rakousku v roce 1976. Byl to přípravek Dolpasse, který obsahoval metamizol. Později byl nahrazen diklofenakem, a tak vznikl přípravek Neodolpasse, registrovaný v Rakousku v roce 1995, v České republice potom v roce 2000.
Farmakodynamika
Diklofenak je stejně jako všechna nesteroidní antiflogistika inhibitorem cyklooxygenázy (COX). Tímto mechanismem blokuje vznik eikosanoidů, především prostaglandinů, prostacyklinu a tromboxanu. Z hlediska inhibice podtypů COX diklofenak preferuje druhý, tzv. inducibilní typ (COX-2). Blokáda COX v periferii i v CNS vede k analgetickému, antiflogistickému, antipyretickému a krátkodobému antiagregačnímu efektu. K výjimečně dobré analgetické a protizánětlivé účinnosti diklofenaku mohou přispívat i další účinky, jako je inhibice lipooxygenázy a fosfolipázy A2, a snad i periferní antinociceptivní efekt zprostředkovaný nepřímou aktivací ATP-senzitivních draslíkových kanálů a centrální inhibice NMDA-receptory zprostředkované hyperalgezie.
Vynikající analgetická účinnost diklofenaku je velmi dobře známa, díky ní je stále jedním z nejpoužívanějších neopioidních analgetik. Je téměř nemožné srovnat analgetickou účinnost různých analgetik mezi sebou, přinejmenším kvůli obtížné kvantifikaci bolesti, velké interindividuální variabilitě účinku, rozdílnosti účinku při jednotlivých typech bolesti a v neposlední řadě i mnohdy podceňované závislosti účinku na dávce. Je však možné alespoň zmínit postavení diklofenaku v tzv. Oxfordské lize analgetik, která srovnává účinnost různých látek v léčbě akutní bolesti. Při hodnocení pomocí parametru NNT (Number Needed to Treat) pro dosažení alespoň 50% úlevy od bolesti po dobu 4–6 hodin je diklofenak v dávce 100 mg per os (což přibližně odpovídá intravenózní dávce 50–75 mg, viz část Farmakokinetika) v první, nejúčinnější skupině analgetik s hodnotou NNT rovnou 1,8. Pro srovnání, odpovídající hodnota NNT pro 10 mg morfinu a 100 mg pethidinu podaných intramuskulárně je 2,9.
Orfenadrin má řadu farmakodynamických účinků, které se zřejmě významným způsobem podílejí na výsledném myorelaxačním a analgetickém efektu. Ovlivňuje jak periferní receptory, tak receptory v CNS. Především je neselektivním antagonistou muskarinových receptorů, vykazuje zhruba 58% blokádu receptorů ve srovnání s atropinem, což přispívá k relaxaci příčně pruhovaného svalstva. Je také antagonistou H1 histaminových receptorů. I tento účinek může přispívat k jeho analgetickému působení. Dále je nekompetitivním antagonistou NMDA receptorů pro excitační aminokyselinu glutamát v CNS, což opět přispívá k analgetickému působení a blokuje také napěťově řízené sodíkové kanály Na V typu 1.7, 1.8 a 1.9 na neuronech, které jsou významné při vnímání bolestivých podnětů. Navíc byl prokázán i jeho inhibiční efekt na zpětné vychytávání noradrenalinu.
Analgetické a myorelaxační účinky orfenadrinu byly prokazovány v řadě experimentů a studií. Působí relaxačně na příčně pruhovaném svalu s patologicky zvýšeným tonem, ale neovlivňuje normální svalový tonus. Orfenadrin vykázal kromě myorelaxačního účinku i analgetický efekt u bolesti muskuloskeletárního původu, pooperační bolesti, chronických bolestí při artritidě a u bolestí hlavy.
Je třeba zdůraznit, že přestože orfenadrin vykazuje řadu mechanismů účinku, žádný z nich se nepřekrývá s mechanismy účinku diklofenaku, ani je naopak neantagonizuje, a tudíž lze jejich kombinaci považovat za velmi výhodnou. Zajímavá práce K. Schafflera a spolupracovníků z roku 2005 porovnávala analgetický účinek fixní kombinace diklofenaku a orfenadrinu s účinky samostatně podávaných účinných látek. Použit byl model zánětu a hyperalgezie vyvolané u zdravých dobrovolníků topickým podáním 1% roztoku kapsaicinu na definovanou plochu kůže zad. Bylo prokázáno, že obě složky kombinace podávané samostatně mají centrální analgetický efekt a fixní kombinace má vyšší účinek než jednotlivé složky.
Farmakokinetika
Diklofenak dosahuje maximálních plazmatických koncentrací bezprostředně po ukončení intravenózní infuze. Po podání dávky 75 mg se průměrné plazmatické koncentrace pohybují okolo 1,9 μg/ml (tj. 5,9 μmol/l). Plateau plazmatických koncentrací přetrvává ještě 3–4 hodiny po podání 2hodinové infuze. Plocha pod křivkou plazmatických koncentrací (AUC) je dvojnásobná ve srovnání s podáním stejné dávky perorálně nebo rektálně, protože diklofenak při těchto způsobech podání podléhá významné nesystémové eliminaci. Při dodržení doporučeného dávkování se farmakokinetické vlastnosti nemění a nehrozí ani kumulace diklofenaku v organismu.
Diklofenak je z 99 % vázán na plazmatické bílkoviny, především na albumin (99,4 %). Jeho distribuční objem je 0,12–0,17 l/kg. Dobře proniká do synoviální tekutiny, kde dosahuje maximálních koncentrací za 2 až 4 hodiny po dosažení Cmax v plazmě. Za zhruba další 2 hodiny koncentrace v synoviální tekutině převýší koncentraci v plazmě a zůstane vyšší po dobu 12 hodin.
Metabolismus diklofenaku probíhá v první fázi hydroxylací a methoxylací na cytochromu P450, zejména formy CYP2C9, částečně i CYP3A4 a CYP2C8; v druhé fázi konjugací s kyselinou glukuronovou uridin-5'-diphosphoglukuronosyl transferázou 2B7 (UGT2B7). Metabolity jsou buď zcela inaktivní, nebo významně méně aktivní než mateřská látka.
Přibližně 60 % podané dávky je vyloučeno močí ve formě glukuronidu s biologickým poločasem eliminace 1–2 hodiny. Méně než jedno procento je vyloučeno močí v nezměněné formě, zbytek je vyloučen ve formě metabolitů žlučí do stolice.
Orfenadrin dosahuje maximálních plazmatických koncentrací během 2 minut od zahájení intravenózní aplikace. Z 90 % se váže na plazmatické proteiny. Orfenadrin je metabolizován v játrech, hlavními aktivními metabolity jsou N-demetylorfenadrin a N,N-didemetylorfenadrin. Eliminace se děje převážně ledvinami do moči s biologickým poločasem v rozmezí 13–20 hodin. Po bolusovém intravenózním podání dávky 50 mg byly popsány průměrné maximální plazmatické koncentrace 82,8 ng/ml, Tmax 3 h, AUC 72h 1565 a průměrný eliminační poločas 25,8 h s poměrně velkou interindividuální variabilitou.
Léková forma a dávkování
Kombinace diklofenaku s orfenadrinem je vyráběna jako infuzní roztok určený k okamžitému podání bez dalšího ředění nebo jiné přípravy v lahvích o objemu 250 ml (přípravek Neodolpasse®). Kromě zjednodušení manipulace to přináší i snížení rizika kontaminace infuze před podáním pacientovi. Infuzní lahev obsahuje 75 mg diklofenaku ve formě sodné soli a 30 mg orfenadrinu ve formě citrátu (16). Podává se intravenózně pomalou kapkovou infuzí v trvání 1,5 až 2 hodin. Vzhledem k osmolaritě roztoku, přibližně 303 mosmol/l, lze přípravek bez obav podat do periferní žíly.
Obvyklé dávkování je jedna infuze každých 24 hodin, v odůvodněných případech lze podat za 24 hodin 2 infuze s minimálním odstupem 8 hodin. Doba trvání léčby nemá překročit 7 dní. U pacientů s těžkou poruchou funkce jater nebo ledvin je podání kontraindikováno.
Nežádoucí účinky a lékové interakce
Fixní kombinace diklofenaku s orfenadrinem vykazuje vynikající bezpečnostní profil. Je to dáno zejména tím, že při dodržení doporučeného dávkování a délky léčby prakticky nedochází k rozvoji typických nežádoucích účinků obou látek, které se vyskytují především při dlouhodobém podávání jejich vysokých dávek. V období let 2003–2010 bylo celosvětově spotřebováno přes 11 milionů dávek přípravku Neodolpasse®, předpokládá se podání více než 3 milionům osob. Přitom bylo regulačním autoritám hlášeno pouze 11 závažných nežádoucích účinků v souvislosti s jeho podáním, z toho v jednom případě byla souvislost vyloučena. Ve třech klinických studiích provedených v letech 2007–2010 byly zjištěny pouze 3 případy nauzey a zvracení po podání přípravku.
Nežádoucí účinky jednotlivých účinných látek kombinace jsou dobře známy a popsány. U diklofenaku jde o společné nežádoucí účinky celé skupiny nesteroidních antiflogistik, které vyplývají z jejich hlavního mechanismu účinku. Jde především o poškození žaludeční sliznice, zvýšené riziko krvácení, poškození ledvin a kardiovaskulárního systému. V poslední době často diskutované zvýšení rizika infarktu a cévních mozkových příhod se týká pouze dlouhodobého (měsíce a roky) podávání dávek přesahujících 150 mg denně. Navíc ani zde zřejmě diklofenak významně nevybočuje z vlastností celé skupiny nesteroidních antiflogistik. Pro krátkodobé podání injekční kombinace s orfenadrinem tudíž nemá význam. Při jejím podání je třeba věnovat zvýšenou pozornost možnosti retence tekutin zejména u pacientů vysokého věku, kontraindikováno je podání u pacientů se závažným stupněm srdečního selhání. Možné působení diklofenaku je i důvodem pro kontraindikaci u osob s aktivní vředovou chorobou nebo cerebrovaskulárním, případně jiným aktivním krvácením a chorobami spojenými se závažnou poruchou koagulace.
U orfenadrinu jsou popisovány nežádoucí účinky ve smyslu parasympatolytického syndromu. Při podání i.v. by připadal v úvahu vliv na kognitivní funkce a kardiovaskulární systém zejména u starších osob, nicméně v používaných dávkách prakticky není zaznamenáván. Kontraindikace vyplývající z těchto účinků jsou zvláště tachyarytmie, glaukom, retence moči a paralytický ileus (16). Je třeba zdůraznit, že nežádoucí účinky orfenadrinu, popisované v odborné literatuře, byly zaznamenávány v minulosti při dlouhodobém užívání průměrně 10x vyšších dávek při léčbě Parkinsonovy nemoci.
Také riziko lékových interakcí je v praxi velmi omezeno dávkovacím schématem intravenózní kombinace obou léčiv. Zvýšené opatrnosti je třeba při současném podávání léků poškozujících žaludeční sliznici nebo zvyšujících riziko krvácení. Z farmakokinetických interakcí diklofenaku připadá v úvahu určité malé riziko zvýšení plazmatických koncentrací digoxinu a methotrexátu. Orfenadrin může potencovat parasympatolytické účinky jiných léčiv, zejména starších antidepresiv, spasmolytik a antihistaminik.
Patofyziologická východiska praktického využití injekční kombinace diklofenaku a orfenadrinu v léčbě bolesti
Křeč (latinsky: spasmus, řecky: hyperkinesis) je patologický stav, kdy dochází k nadměrnému či dlouhodobému stahu kosterní nebo hladké svaloviny. Mechanismus vzniku křečí tkví v inervaci svalů, konkrétně ve vyšší dráždivosti nervů či neustálém dráždění nervových synapsí různými mediátory. Spasmus může postihovat jeden sval nebo celé svalové skupiny. Ve své podstatě je svalový spasmus stav zvýšeného klidového napětí a stahů svalů v určitém místě, který se těžko dostává pod kontrolu. Může nastat v téměř každém svalu na těle. Svalové napětí (tonus) je reflexně udržované napětí, které se mění v závislosti na informacích z periferních receptorů a na informacích z CNS. Je výsledkem působení reflexního oblouku segmentárních míšních reflexů (tzv. γ-kličky, míšní regulace svalového napětí), dále vestibulárního systému (labyrintová regulace), tonoregulačních struktur mozkového kmene (tzv. extrapyramidových drah), mozečku (ten zvyšuje svalový tonus) a centrálního motoneuronu (má pravděpodobně tlumivý vliv na svalové napětí). Patologické svalové napětí je pak nefyziologický stav daný nadměrným přetěžováním daného svalu nebo svalové skupiny (zádové, krční svalstvo), může ale být i příznakem, který ukazuje na závažné poškození nervového systému. Pokud dojde k poruše v pyramidové dráze, pak následuje spasticita, kdy sval klade při pasivním natahování stále větší odpor. Po uvolnění držení se končetina vrací do původní polohy, avšak po dosažení určité hranice pohybu odpor svalu náhle zmizí a končetinou lze pohybovat. Jedná se o tzv. fenomén kapesního nože.
Čistá porucha v mimopyramidovém systému hybnosti (hlavně substantia nigra) vyvolá rigiditu, tj. zvýšení plastického svalového napětí. Odpor svalu proti pasivnímu napínání je stabilní a při velmi pomalém pasivním pohybu končetiny jsou viditelné sakadovité změny svalového napětí. Jedná se o tzv. fenomén ozubeného kola.
Skutečnost, že patologický svalový spasmus vyvolává bolest a obráceně, že lokální bolest způsobí obranný svalový spasmus, je zkoumána od počátku 50. let. Whittaker a spol. prokázal, že patologický svalový spasmus je vůlí neovlivnitelný a že je vyvolán zvýšenou elektrickou aktivitou motorických neuronů. Ve své práci poukázal na 4 základní odlišnosti orfenadrinu od ostatních svalových relaxancií. Na rozdíl od nich a) nepůsobí svalovou paralýzu, b) neovlivňuje křeče navozené strychninem, c) neovlivňuje spinální reflexy ani polysynaptický motorický přenos a d) působí centrálně. Již na počátku 60. let bylo prokázáno, že bolest způsobenou patologickým svalovým tonem lze objektivizovat pomocí elektromyografie (EMG), která pak byla následně využívána v klinickém hodnocení farmak ovlivňujících patologický svalový spasmus. Masterson a spol. měřením prokázal, že akutní bolest způsobená hyperaktivitou a svalovým spasmem koreluje s vyšší amplitudou na EMG záznamu. Klinická úleva po podání orfenadrinu i dalších analgetik byla objektivizována normalizací EMG amplitudy.
Klinická východiska praktického využití injekční kombinace diklofenaku a orfenadrinu v léčbě bolesti
Orfenadrin citrát je od druhé poloviny 60. let hojně používán pro své svalově relaxační účinky buď v monoterapii, nebo v kombinaci s dalšími analgetiky (chlormezanon, paracetamol). Hunskaar a spol. prokázal také jeho přímé antinociceptivní účinky a v případech svalového spasmu kombinovaný svalově relaxační a středně silný analgetický efekt. Vynikající centrální spasmolytický efekt orfenadrinu byl prokázán rovněž u paraplegických pacientů se zvýšenou spasticitou. Casale a spol. podával 60 mg orfenadrinu pacientům s míšním poraněním a spastickou hypertonií. Prokázal, že již po 30 minutách od podání spasmus povolí a umožní efektivní rehabilitaci. Svůj veliký potenciál v léčbě bolesti prokázal orfenadrin jak při zvládání pooperační akutní bolesti, tak chronické bolesti u pacientů s artrózou velkých kloubů nebo při nejrůznějších muskuloskeletálních onemocněních. Je efektivní u bolestí hlavy způsobených hyperaktivitou a spasmem krčního a zádového svalstva. Richards a spol. považuje orfenadrin za ideální svalové relaxans pro léčbu patologických spasmů a bolestivých kontraktur u pacientů s revmatoidní artritidou. V roce 2010 publikoval Gombotz a spol. výsledky své dvojitě zaslepené, randomizované, multicentrické, placebem kontrolované klinické studie u pacientů po totálních náhradách kyčelního klubu. Prokázal, že analgezie kombinací orfenadrin-diklofenak je nejen účinná, ale že je možné vyvarovat se v perioperačním období podávání opioidů. Tervo a spol. se zaměřil na efekt orfenadrinu na zkrácení doby imobility při akutní bolesti zad. Ve dvojitě zaslepené, randomizované studii orfenadrin zkracoval dobu imobility z 12,9 na 8,6 dní ve srovnání s paracetamolem.
Praktické využití injekční kombinace diklofenaku a orfenadrinu v léčbě bolesti
V reálné klinické praxi je fixní kombinace orfenadrinu a diklofenaku (přípravek Neodolpasse®) vyžívána k infuzní léčbě akutní exacerbace vertebrogenního algického syndromu a v pooperační léčbě bolesti.
Bolesti zad jsou nejčastěji způsobeny primárním vertebrogenním onemocněním. Roční prevalence výskytu bolestí zad se udává mezi 15–45 %, celoživotní prevalence činí 60–90 %. Chronické bolesti bederní páteře se vyskytují u 3–7 % dospělé populace a jsou příčinou 1/3 všech pracovních neschopností. Nejčastěji bývá postižena bederní oblast páteře, dále krční a hrudní, a to v přibližném poměru 4 : 2 : 1. Vzrůstající četnost výskytu tohoto onemocnění tak představuje významný socioekonomický problém.
Zatímco pozice infuzní terapie v pooperační bolesti je obsažena v doporučených postupech pro léčbu pooperační bolesti, její pozice v léčbě chronické bolesti stanovena není. Nejsou dána indikační kritéria, vhodné diagnózy ani optimální složení infuzní analgetické směsi. Nejasné jsou vzájemné kompatibility jednotlivých složek, vhodné nosné roztoky a stabilita připravených směsí. Není přesně stanovena příprava infuzních analgetických směsí z hlediska souladu s SPC jednotlivých složek, vyjádřená například rozporem mezi nutností ředit i.v. guaifenesin v 5% glukóze a reálnou praxí ředění do fyziologického roztoku. Stejně tak chybí data porovnávající efektivitu směsí různých složení nebo četnost chyb při přípravě. Indikace a složení infuzní terapie se nejčastěji řídí zvyklostmi pracoviště, které se vzájemně od sebe často velmi liší.
Hlavní účinnou složkou většiny tradičních infuzních analgetických směsí je guaifenesin, který také vykazuje jisté centrálně myorelaxační účinky v léčbě patologického svalového spasmu. Na rozdíl od orfenadrinu u něj však převažují účinky anxiolytické. To může samo o sobě vést k celkovému uvolnění nemocného a tím i k povolení strnulých svalů především v oblasti krku a ramen. Biologický poločas guaifenesinu je 20–30 minut, proto vyžaduje opakované podávání. Ve vyšších dávkách může způsobit klinicky významnou relaxaci skeletálního svalstva s normálním tonem. Obecně není vhodný k léčbě pooperační bolesti.
Přípravek Neodolpasse® s účinkem přetrvávajícím 24 hodin, bez komplikací spojených s přípravou infuzních směsí, se spektrem účinku zahrnujícím nociceptivní i neuropatickou bolest a centrálně myorelaxačním účinkem je alternativou klasické infuzní terapie. Nejčastější indikací jsou bolesti pohybového aparátu, zejména bolesti zad s radikulární složkou nebo bez ní, periferní neuropatické bolesti, případně komplexní regionální bolestivý syndrom nebo úžinové syndromy.
Zařazení přípravku Neodolpasse® do protokolů léčby pooperační bolesti je kromě jeho vynikající účinnosti a dostatečné délky účinku postaveno na možnosti omezit časovou zátěž kladenou na ošetřovatelský personál a na samotné pacienty. V níže uvedeném modelu třídenní i.v. léčby bolesti jsou srovnávány varianty založené na klinických zkušenostech s i.v. léčbou přípravkem Neodolpasse®, i.v. léčbou paracetamolem v kombinaci s i.v. metamizolem nebo i.v. diklofenakem. U všech variant nadále zůstává možnost kombinovat daný režim s opiáty. Z uvedeného vyplývá, že při léčbě přípravkem Neodolpasse® může docházet ke snížení počtu i.v. aplikací. Náklady spojené s jednotlivými intervencemi při započtení zdravotnických prostředků nutných pro i.v. aplikaci a při započtení reálných cen jednotlivých léčiv (paracetamol 22 Kč/1 g, diklofenak 11 Kč/75 mg, metamizol 12 Kč/1 g) se pohybují ve všech variantách v rozmezí 820–830 Kč (zjištěno místním šetřením). V těchto nákladech není zahrnuta práce sester ani fakt, že i.v. diklofenak by se lege artis měl upravovat přidáním bikarbonátu pro úpravu pH.
Přípravek Neodolpasse® je zařazován do léčebných protokolů nejen po celkové anestezii, ale i po lokální anestezii/analgezii – zde z důvodu léčby bolesti a spasmů spojených s polohou nebo s fixací pacienta při operačním výkonu, které nejsou pokryty lokálním anestetickým/analgetickým efektem.
Možnosti využití injekční kombinace diklofenaku s orfenadrinem v reálné klinické praxi lze shrnout následujícím způsobem:
- Akutní léčba vertebrogenního algického syndromu
- Pooperační bolest se složkou patologického svalového spasmu
- po všech ortopedických operacích (náhrady kloubů, plastiky vazů, artroskopie)
- po operacích páteře
- po operacích v hrudní chirurgii, včetně laparoskopických výkonů
- po výkonech v břišní chirurgii včetně laparoskopických výkonů
- po gynekologických operacích včetně laparoskopických výkonů
- po neurochirurgických zákrocích
- Bolest při revmatických onemocněních
- Tenzní bolesti hlavy spojené se zvýšeným tonem perikraniálního a krčního svalstva
- Bolest a spasmy kosterního svalstva u pacientů upoutaných na lůžko (ARO pacienti) nebo bolesti nepokryté lokální anestezií/analgezií
Bezpečnost a snášenlivost injekční kombinace diklofenaku a orfenadrinu v léčbě bolesti
Orfenadrin má obecně velmi málo nežádoucích účinků, většina z nich se objevuje až při předávkování, nejčastějšími jsou rozmazané vidění, zmatenost a úzkost. Doposud publikované klinické studie neprokázaly ovlivnění hemokoagulace orfenadrinem, ovlivnění hemokoagulace nebylo popsáno ani při in vitro testování. Malizia a spol. popisuje u 8 pacientů se závažným předávkováním orfenadrinem v suicidálním pokusu jeho kardiotoxické účinky s maligními arytmiemi. Pacienti však užili dávky 500–2 500 mg orfenadrinu, tedy 16–83x více, než obsahuje přípravek Neodolpasse®.
Druhá účinná látka přípravku, diklofenak, patří do skupiny nesteroidních antiflogistik. Způsobuje inhibici cyklooxygenázy. Cyklooxygenáza má dva izoenzymy – COX-1, který cestou prostaglandinů ovlivňuje některé fyziologické funkce. Ve vztahu k hemokoagulaci je COX-1 důležitý pro syntézu tromboxanu A2, který produkují aktivované destičky. TXA2 zvyšuje jejich adheznost a navozuje vazokonstrikci. Inhibice COX-1 tedy in vitro negativně ovlivňuje adherenci krevních destiček. Druhý izoenzym COX-2 se aktivuje při zánětu; vzniklé prostaglandiny senzibilizují nocisenzory, podporují zánět a horečku. COX-2 je významný pro tvorbu prostacyklinu, který tlumí agregaci trombocytů a působí vazodilataci. Jeho inhibicí naopak in vitro dochází k výraznější agregaci krevních destiček. Diklofenak inhibuje oba izoenzymy, čímž má na agregaci trombocytů smíšený klinický efekt. Opakovaně byly publikovány závěry, že diklofenak klinicky významně inhibuje agregaci destiček, inhibuje tvorbu krevního koagula a zhoršuje tak perioperační krvácení. Autoři těchto prací však podávali významně vyšší dávky diklofenaku, než obsahuje přípravek Neodolpasse®. U pacientů, kteří trpí hemofilií, bylo i po podání 75 mg diklofenaku prokázáno klinicky závažnější krvácení. Naše zkušenosti s bezprostřední pooperační infuzí Neodolpasse® naopak zcela korespondují se závěry dalších odborníků, kteří prokázali, že 75 mg diklofenaku neovlivňuje agregaci krevních destiček in vivo, nemá vliv na hemokoagulaci, respektive nemá vliv na velikost pooperační krevní ztráty ani na počet podaných krevních transfuzí. Měřením viskoelastických vlastností plné krve pacientů v perioperačním období jsme prokázali, že intravenózní infuze 250 ml přípravku Neodolpasse® neovlivní bezprostředně po operaci tvorbu ani kvalitu krevního koagula.
Závěr
Kombinace diklofenaku a orfenadrinu je vysoce efektivní díky příznivému vlivu na různé složky bolesti, výhodným farmakokinetickým vlastnostem, jednoduché aplikaci a vynikajícímu bezpečnostnímu profilu. Pro parenterální podání je k dispozici ve formě přípravku Neodolpasse®. Přítomnost myorelaxační složky jej předurčuje k využití nejen v oblasti vertebrogenního algického syndromu. Orfenadrin vykazuje samostatný dlouhodobý analgetický účinek na nociceptivní i neuropatickou bolest a kombinace s diklofenakem se využívá rovněž v léčbě široké škály pooperačních bolestí s cílem snížit počet nutných intravenózních aplikací, urychlit mobilizaci pacienta a eliminovat časovou zátěž zdravotnického personálu.
Literatura
- Altman R, Bosch B, Brune K, Patrignani P, Young C. Advances in NSAID development: evolution of diclofenac products using pharmaceutical technology. Drugs. 2015; 75(8): 859–77.
- Sneader W. Drug Discovery: A History. John Wiley & Sons, London, 2005.
- Scholer DW, Ku EC, Boettcher I, Schweizer A. Pharmacology of diclofenac sodium. Am J Med. 1986; 80(4B): 34–8.
- Gan TJ. Diclofenac: an update on its mechanism of action and safety profile. Curr Med Res Opin. 2010; 26(7): 1715–31.
- The Oxford League Table of Analgesic Efficacy. Dostupné na: http://www.medicine.ox.ac.uk.
- Syvälahti EK, Kunelius R, Laurén L. Effects of antiparkinsonian drugs on muscarinic receptor binding in rat brain, heart and lung. Pharmacol Toxicol. 1988; 62(2): 90–4.
- Rumore MM, Schlichting DA. Analgesic effects of antihistaminics. Life Sci. 1985; 36(5): 403–16.
- Kornhuber J, Parsons CG, Hartmann S et al. Orphenadrine is an uncompetitive N-methyl-D-aspartate (NMDA) receptor antagonist: binding and patch clamp studies. J Neural Transm Gen Sect. 1995; 102(3): 237–46.
- Desaphy JF, Dipalma A, De Bellis M et al. Involvement of voltage-gated sodium channels blockade in the analgesic effects of orphenadrine. Pain. 2009; 142(3): 225–35.
- Hunskaar S, Donnell D. Clinical and pharmacological review of the efficacy of orphenadrine and its combination with paracetamol in painful conditions. J Int Med Res. 1991; 19(2): 71–87.
- Schaffler K, Reitmeir P, Gschanes A, Eggenreich U. Comparison of the analgesic effects of a fixed-dose combination of orphenadrine and diclofenac (Neodolpasse) with its single active ingredients diclofenac and orphenadrine: a placebo-controlled study using laser-induced somatosensory-evoked potentials from capsaicin-induced hyperalgesic human skin. Drugs R D. 2005; 6(4): 189–99.
- Fowler PD, Shadforth MF, Crook PR, John VA. Plasma and synovial fluid concentrations of diclofenac sodium and its major hydroxylated metabolites during long-term treatment of rheumatoid arthritis. Eur J Clin Pharmacol. 1983; 25(3): 389–94.
- Davies NM, Anderson KE. Clinical pharmacokinetics of diclofenac. Therapeutic insights and pitfalls. Clin Pharmacokinet. 1997; 33(3): 184–213.
- Ellison T, Snyder A, Bolger J, Okun R. Metabolism of orphenadrine citrate in man. J Pharmacol Exp Ther. 1971; 176(2): 284–95.
- Lee SY, Oh HJ, Kim JW, Kim YG, Moon CJ, Lee EH. Pharmacokinetic study of orphenadrine using high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). J Chromatogr B Analyt Technol Biomed Life Sci. 2006; 839(1-2): 118–23.
- SPC Neodolpasse®. Dostupné na www.sukl.cz.
- Neodolpasse: Clinical Expert Statement. Fresenius Kabi 2012. Dostupné na www.researchgate.net.
- PRAC recommends the same cardiovascular precautions for diclofenac as for selective COX-2 inhibitors. Dostupné na www.ema.europa.eu.
- Trelle S, Reichenbach S, Wandel S et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ. 2011; 342: c7086.
- Ambler Z. Základy neurologie. 6. vydání. Praha : Galén, 2006, s. 66–67. ISBN 80-7262-433-4.
- Whittaker VB. The effect of orphenadrine citrate by injection in skeletal muscle spasm using an electromyographic examination technique. Br J Clin Pract. 1969 Mar; 23(3): 115–9.
- Masterson JH, White AE. Electromyographic Validation of Pain Relief: A Pilot Study in Orthopedic Patients. Amer J of Orthopedics. 1966; 2: 36–40.
- Valtonen EJ. A Controlled Clinical trial of Chlormezanone, Orphenadrine, Orphenadrine/Paracetamol and Placebo in the Treatment of painful Skeletal Musile Spasm. Annals of Clinical Research. 1975; 7: 85–88.
- Hunskaar S, Donnell D. Clinical and Pharmacological Review of the Efficacy of Orphenadrine and Its Combination with Paracetamol in Painful Conditions. J of Int Med Res. 1991; 19: 71–87.
- Casale R, Glynn CHJ, Buonocore M. Reduction of Spastic Hypertonia in Patiens with Spinal Cord Injury: A Double-Blind Comparison of Intravenous Orphenadrine Citrate and Placebo. Arch Phys Med Rehabil. 1995; 76: 660–664.
- Winter L, Post A. Analgetik Combinations with Orphenadrine in Oral Post-Surgical Pain. J Int Med Res. 1979; 7: 240–243.
- Uitz E, Aglas F, Wurm A, Rainer F. Diclofenac/Orphenadrin-Infusionstherapie bei Patienten mit aktivierten Arthrosen. Wien Med Wochenschr. 1998; 7: 179–183.
- Aglas F, Fruhwald FM, Chlud K. Ergebnisse einer Anwendungsbeobachtung mit Diclofenac/Orphenadrin-Infusionen bei Patienten mit muskuloskelettalen Krankenheiten und Funktionsstoerungen. Acta Med Austriaca. 1998; 25: 86–90.
- Bakris GL, Mulopulos GP, Tiwari S, Franclin C. Orphenadrine Citrate. Illinois Med Journal. 1982; 2: 06–108.
- Richards BL, Whittle SL, Buchbinder R. Musile relaxans for pain management inrheumatoid arthritis. Cochrane Database of Systematic Reviews. 2012; 1: CD008922.
- Gombotz H, Lochner R, Sigl R et al. Opiate sparing effect of fixed combination of diclophenac and orphenadrine after unilateral total hip arthroplasty: A double-blind, randomized, placebo-controlled, multi-centre clinical study. Wien Med Wochenschr. 2010; 160/19-20: 526–534.
- Tervo T, Petaja L, Lepisto P. A controlled clinical trial of a muscle relaxant analgesic combination in the treatment of acute lumbago. Br J Clin Pract. 1976 Mar; 30(3): 62–4.
- Hakl M. Léčba bolestí zad. Čas Lék čes. 2018; 157: 62–66.
- Adamová B. Bolesti páteře. In: Hakl M a kol. Léčba bolesti. Praha: Mladá fronta, 2013: 170–182.
- Collaku A, Yue Y, Reed K. Efficacy and safety of guaifenesin for upper back, neck, and shoulder pain: a Phase II proof-of-concept, multicenter, placebo-controlled, repeat-dose, parallel-group study. J Pain Res. 2017 Mar 21; 10: 669–678. doi: 10.2147/JPR.S126296. eCollection 2017.
- Bojanovsky J, Chloupkova K. Comparative therapeutic effects of Meprobamate and Guaiacuran in anxiety neuroses. Act Nerv Super. 1962; 4: 232–3.
- See S, Ginzburg R. Skeletal muscle relaxants. Pharmacotherapy. 2008; 28: 207–13.
- MedlinePlus [online]. U.S. National Library of Medicine 8600 Rockville Pike, Bethesda, MD 20894 [cit. 25.5.2018]. Dostupné z: https://medlineplus.gov/druginfo/meds/a682162.html
- Malizia E, Sarcinelli L, Pascarella M et al. Cardiotoxicity from Orphenadrine Intoxications in Humans. Arch Toxicol Suppl. 1980; (4): 425–427.
- Gilman AG, Rall TW, Nies AS. The Pharmacological Basis of Therapeutics. 10th Ed; Mc Graw Hill: 2001.
- Sanyuktha S, Sharath K, Biju T, Nitin S, Arvind S, Devanand S. NSAIDs and Bleeding in Periodontal Surgery Journal of Clinical and Diagnostic Research. 2014 May; Vol-8(5): ZC17-ZC20.
- Bowen B, Yuan Y, James C, Rashid F. Short-Term Use of High-Dose Ibuprofen Linked to GI Bleeding. Clin Gastroenterol Hepatol. 2005; 3: 1–5.
- Mc Intyre BA, Philip RB, Inwood MJ . Effect of ibuprofen on platelet function in normal subjects and hemophiliac patients. Clin Pharmacol Therap. 1978; 245: 616–21.
- Winkler SH, Barta S, Kehl V, Schröter C, Wagner F, Grifka J, Springorum HR, Craiovan B. Perioperative blood loss and gastrointestinal tolerability of etoricoxib and diclofenac in total hip arthroplasty (ETO-DIC study): a single-center, prospective double-blinded randomized controlled trial. Curr Med Res Opin. 2016; 32(1): 37–47.
- Ragavan J, Zheong U, Majakal V. Post-op pain and blood loss in total knee arthroplasty: an RCT using periarticular injection with diclofenac-based multimodal drugs. J Med Assoc Thai. 2014 Dec; 97(12): 1332–7.
- Gupta A, Jakobsson J. Acetaminophen, nonsteroidal anti-inflammatory drugs, and cyclooxygenase-2 selective inhibitors: an update. Plast Reconstr Surg. 2014 Oct; 134(4 Suppl 2): 24S–31S.
- Vymazal T, Beroušek J. Neodolpasse v časném pooperačním období neovlivňuje tvorbu krevního koagula – prospektivní kohortové sledování. Klin Farmakol Farm. 2017; 31(1): 10–12.

 redakce
redakce