Výhody lokálních forem antirevmatik v léčbě akutní bolesti
Prim. MUDr. Marek Hakl, Ph. D.
Bolest patří mezi jeden z prvních vjemů se kterými se člověk ve svém životě setkává a který ho doprovází po celou dobu jeho existence. Světová zdravotnická organizace (SZO) i mezinárodní společnost pro léčbu bolesti definují bolest jako: „Nepříjemný senzorický a emocionální prožitek spojený se skutečným či potencionálním poškozením tkání nebo zážitek, který je v termínech takového poškození popisován. Bolest je vždy subjektivní“.
Chronická bolest patří mezi nejrozšířenější medicínské problémy současnosti s výrazným socio-ekonomickým dopadem. Prevalence chronické bolesti v ekonomicky rozvinutých státech se udává kolem 20%. Frekvence výskytu chronické bolesti v jednotlivých evropských zemích se liší jen mírně. Jedna z mála panevropských studií provedená v roce 2006 v 15 evropských zemích a Izraeli prokázala, že 19% dospělého obyvatelstva má zkušenosti s dlouhodobou bolestí. Studie ze severských zemí hovoří o 24,2% výskytu chronické bolesti v Norsku a 20,2% výskytu ve Švédsku. Nejnižší výskyt je ve Španělsku, Irsku a Velké Británii (12-30%), nejvyšší naopak v Itálii, Polsku a Norsku (26-30%). Toto procento se v důsledku stárnutí populace postupně zvyšuje.
Obdobné výsledky ukazují i studie prováděné na populaci v České republice, jedno z mála českých sledování udává, že bolest je důvodem asi 20% návštěv u praktického lékaře.
Dopady chronické bolesti výrazně negativně ovlivňují kvalitu života pacientů: 27% lidí s chronickou bolestí se cítí kvůli její přítomnosti sociálně izolováno, 50% z nich si myslí, že bolest výrazně ovlivňuje jejich vztahy s okolím, 29% se obává v důsledku bolesti ztráty zaměstnání a 36% udává, že chronická bolest má vliv na jejich rodinný život.
Patofyziologie bolesti
Pro správnou volbu analgetika nebo analgetické kombinace je důležité rozlišovat mezi bolestí akutní, chronickou, nociceptivní , neuropatickou, psychogenní a smíšenou.
Dělení bolesti
Nociceptivní bolest vzniká podrážděním nociceptorů zahrnujících nocisenzory (volná nervová zakončení v tkáních, aktivují se pouze při bolestivé stimulaci), mechanosenzory (Vaterova-Paciniho tělíska) a polymodální receptory (reagují na teplo a chlad). Podle umístění receptorů rozlišujeme bolest somatickou a viscerální. K nociceptivní bolesti řadíme bolesti pohybového aparátu (osteoartrózy, artritidy, degenerativní změny páteře), bolesti vnitřních orgánů a většinu stavů akutní bolesti. Ve farmakoterapii nociceptivní bolesti jsou léky první volby analgetika.
Neuropatická bolest je způsobená lézí nebo dysfunkcí somtosenzorického nervového systému. Podle lokalizace poškození dělíme neuropatickou bolest na centrální, vznikající poškozením centrálního nervového systému a periferní, vznikající v důsledku periferní nervové léze.
Podle dalšího dělení rozlišujeme neuropatickou bolest stimulovanou a bolest spontánní. Mezi stimulované bolesti patří alodynie (bolest vyvolaná podnětem, který ji za normálních okolností nevyvolává) a hyperalgezie (snížení prahu pro bolest v postižené oblasti). Spontánní bolestivé stavy podle průběhu v čase dělíme na: kontinuální, intermitentní a paroxysmální. Neuropatická bolest je obvykle ohraničena příslušnou inervační oblastí a bývá spojena se senzitivním deficitem, hyperpatií a alodynií. Neuropatická bolest může časově navazovat na neurogenní lézi, stejně tak se však může objevit s časovou prodlevou. Pacienti nejčastěji charakterizuji bolest jako: ostrou, palčivou, vystřelující nebo bodavou. Velmi často je udáváno noční zhoršení bolesti.
Smíšená bolest zahrnuje stavy, na kterých se podílí více předchozích typů bolesti. V praxi se nejčastěji setkáváme s FBSS (failed back surgery syndrome) – bolestí po operaci bederní páteře. V oblasti zad pacienti trpí nociceptivní složkou bolesti, v distribuční oblasti postižených nervových kořenů naopak převažuje neuropatická složka. Mezi možné etiologické komponenty patří epidurální fibróza a adhezivní arachnoiditis. Terapie se odvíjí od převažující účasti jednotlivých složek. Léčba je často velmi složitá a uplatňují se zde i metody invazivní (kaudální blokády, neuromodulace).
Psychogenní bolest. U této bolesti převažuje nebo dominuje psychická komponenta. Především u depresivních poruch a některých neuróz je bolest somatickou projekcí primárních obtíží. Nejčastěji si pacienti stěžují na bolesti břicha a zad. Základ terapie tvoří psychofarmaka a psychoterapie.
Akutní bolest
Akutní bolest je zpravidla náhle vzniklý bolestivý stav trvající několik hodin, dnů, výjimečně týdnů. Akutní bolest je „fyziologická“, plní svoji základní ochrannou funkci organismu, kdy slouží jako signál probíhajícího onemocnění nebo poškození. Akutní bolest bývá dobře lokalizovatelná, ostrého až palčivého charakteru, řadíme k ní bolest pooperační, traumatickou, porodní a bolest při některých vnitřních onemocněních. Akutní bolest má výrazný vliv na celý organismus, aktivuje sympatikus, aktivuje neuroendokrinní, imunitní a zánětlivé reakce, katabolismus, imunosupresi, zvyšuje spotřebu kyslíku myokardem, snižuje motilitu gastro-intestinálního traktu a podílí se na řadě dalších změn.
Farmakoterapie bolesti
Cílem léčby je zmírnění až odstranění bolesti, zvýšení funkční kapacity, zajištění nerušeného spánku a celkové zlepšení kvality života.
Strategie léčby bolesti vychází ze třístupňového žebříčku Světové zdravotnické organizace (WHO) publikovaného poprvé v roce 1986 a původně určeného pro léčbu bolesti onkologické. Záhy byl však zcela přejat pro léčbu bolesti neonkologické, akutní i chronické. Žebříček je tvořen třemi základními stupni terapie, první stupeň pro nejméně intenzivní bolest zahrnuje neopioidní analgetika, druhý stupeň pro intenzivnější bolest přidává k neopioidním analgetikům slabý opioid a ve třetím stupni je slabý opioid nahrazen opioidem silným. Celou terapii je možné doplňovat koanalgetiky (antikonvulziva, antidepresiva) pro léčbu specifických bolestivých stavů a adjuvantní medikací k potlačení nežádoucích účinků analgetik (antiemetika, laxativa). V indikovaných případech onkologické bolesti lze nově použít systém „elevátor“ (výtah), kdy při velmi intenzivní bolesti a předpokladu rychlého navyšování analgetik je možné druhý stupeň terapie (slabý opioid + neopioidní analgetikum) přeskočit a na neopioidní analgetika navázat přímo nízkou dávkou silného opioidu.
Třístupňový žebříček WHO
|
|
|
III. stupeň – silná bolest |
|
|
I. stupeň – mírná bolest |
II. stupeň – středně silná bolest |
Silné opioidy +/– neopioidní analgetikum |
|
|
Slabé opioidy + neopioidní analgetikum |
|||
|
Neopioidní analgetikum |
|||
|
+/– koanalgetika a pomocná léčiva |
|
||
Neopioidní analgetika tvoří skupina analgetik antipyretik (paracetamol, metamizol) a poměrně nesourodá skupina nesteroidní antiflogistik (NSA).
Nesteroidní antiflogistika
Princip účinku nesteroidních antiflogistik spočívá převážně v blokádě enzymů cyklooxygenázy (COX), která mění kyselinu arachidonovou na prostaglandiny. Existují dva isoenzymy COX-1 a COX-2. Forma COX-1 je syntentizována v řadě orgánů (játra, ledviny, žaludeční sliznice, krevní destičky) a podílí se na jejich fyziologické funkci. Hladina COX-2 výrazně stoupá při traumatu a zánětu a je spoluzodpovědná za zánětlivé a bolestivé projevy onemocnění. K dispozici máme v současné době řadu NSA, dělících se podle selektivity blokády obou COX. Optimální NSA pro tlumení akutních bolestí zad má razantní nástup efektu, dobrou účinnost a zvýšenou vazbu na COX 2. NSA mají v léčbě akutních bolestí zad NNT 2-3, tedy musí být léčení 2-3 pacienti aby alespoň u jednoho z nich bylo dosaženo minimálně 50% úlevy od bolesti.
Nesteroidní antiflogistika lze podávat jak systémově , tak i lokálně. Topická forma NSA bývá často neprávem podceňována.
Kůže je největším orgánem v lidském těle. Díky svému uložení na povrchu těla je kůže důležitým orgánem imunitního systému, kdy tvoří významný bariérový systém pro vnější infekci, který je však schopen i biologické resorbce. Tato schopnost kůže je využívána po celá staletí, kdy léčba probíhala pomocí zábalů a aplikací různých mastí. Vstřebávání probíhá prostou difůzí na základě koncentračního gradientu. Míra tohoto vstřebávání záleží na řadě faktorů, především chemickými vlastnostmi sledovaných látek a použitým vehikulem. Proto je cílem výrobců lokálních NSA použití takového nosiče, který umožní dosáhnout co nejvyšší lokální koncentrace. Kvalitu vstřebávání lze hodnotit několika farmakokinetickými parametry, hloubkou a rychlostí vstřebávání, koncentrací, plazmatickou hladinou a dalšími. Nejvýznamnějším parametrem je však biologický efekt, který se odvíjí nejenom od množství vstřebané účinné látky, ale i od její biologické aktivity. Při porovnávání vstřebávání jednotlivých účinných látek ve formě nasycených roztoků kůží v souboru indometacin, ketoprofen, diclofenak, piroxicam, tenoxicam, ketoralac a aceclofenac dosahoval nejvyšší hodnoty penetrace diclofenak. Další studie porovnávala aktivitu 12 nesteroidních antiflogistik u lipofilního vehikula - lehkého minerálního oleje in vivo. Z výsledků vyplývala nejvýšší aktivita u ibuprofenu a nebumetonu, vysoké hodnoty vykazovaly i naproxen, piroxicam a diclofenak.
Další studie sledovala vliv indometacinu, ketoprofenu, diclofenaku, piroxicamu, tenoxicamu a ketoralacu na inhibici COX2 in vitro po předchozí stimulaci na kulturu lidských fibroblastů. Nejvyšší ihibici v závislosti na dávce vykazoval diclofenak, dobře si vedl i indometacin a ketorpofen. Autoři na základě této inhibice stanovili index lokální protizánětlivé aktivity (ITAA), který určuje relativní účinnost topických NSA v procentech. Hodnoty ITAA byly nejvyšší u diclofenaku a ketoralacu .
U lidí byly sledovány i hladiny plazmatické hladiny NSA a jejich koncentrace v synoviální tkáni a synoviální tekutině. Nejvyšších koncentrací dosáhl opět diclofenak. Synoviální hladiny v kolenních kloubech u nemocných s bilaterálním postižením byly vyšší v kloubu, který byl léčen diclofenakem něž v kontraleterálním neléčeném kloubu. Plazmatické hladiny diclofenaku přitom byly asi 6x nižší než při systémové aplikaci diclofenaku.
V roce 1998 publikoval Moore metaanalýzu klinických studií se zaměřením na lokální NSA. V metaanalýze bylo zahrnuto 86 studií s více než 10 000 pacientů. Kritériem úspešnosti bylo snížení intenzity bolesti o 50%, byl stanoven relativní přínos terapie a NNT (number need to treat – počet léčených pacientů, aby alespoň u jednoho došlo k 50% úlevě od bolesti). U akutních traumatických stavů byl ve studiích kontrolovaných placebem stanoven relativní přínos 1,7 (1,5-1,9), NNT bylo 3,9 (3,4-4,4). Významnou účinnost prokázaly ketoprofen (NNT 2,6), felbinac (NNT 3,0), ibuprofen (NNT 3,5) a piroxicam (NNT 4,2). V této studii nebyl zahrnut diclofenak. U chronických onemocnění prokázaly placebem kontrolované studie relativní přínos 2,0 (1,5-2,7), NNT bylo 3,1 (2,7-3,8).
V literatuře však nejsou porovnávána pouze jednotlivá topická NSA vůči sobě a placebu, nalezneme i práce porovnávající jejich efektivitu ve srovnání se systémově podávanými NSA. Derry a Ostor ve svých metaanalýzách vyhledali v různých databázích (MEDLINE, EMBASE aj.) dostupné klinické studie provedené do roku 2012. Zařazeny byl randomizované zaslepené studie, ve kterých byli pacienti sledováni nejméně 2 týdny v nichž byla topická NSA porovnávána s placebem nebo perorálními formami NSA. Do studií byli zařazeni pacienti trpící chronickou bolestí pohybového aparátu. Jako úspěšná byla považována léčba s minimálně 50% úlevou od bolesti. Vedle přínosu pro pacienty byly sledovány i nežádoucí účinky a důvody přerušení léčby.
Celkem bylo do metaanalýzy zařazeno 34 studií trvajících 2-12 týdnů s celkovým počtem 7688 pacientů. Ve srovnání s placebem studie prokázaly zejména v případě diclofenaku vyšší účinnost než placebo. Studie porovnávající lokální a perorální NSA ukázala srovnatelnou účinnost. V průměru došlo k 55% úlevě od bolesti u pacientů s topickou formou a 54% úlevou u pacientů se systémově aplikovanými NSA. Přitom použití lokálních NSA nebylo spojeno se závažnějšími nežádoucími účinky (nejčastěji kožní iritace, pruritus, suchost kůže). Výraznější nežádoucí účinky byly ve skupinách perorálně užívaných NSA, především ze strany gastrointestinálního a kardiovaskulárního systému.
Benefit lokálních NSA oproti perorálním byl v metaanalýze prokázán u pacientů s osteoartrózou, nikoliv však u pacientů jiných bolestivých stavů pohybového aparátu, jako jsou bolesti zad či muskuloskeletální bolesti. Podle komentáře k metaanalýze uveřejněné v časopise Evidence Based Medicine může být příčinou i menší přesnost definice diagnózy v takto zaměřených studiích. Podle autorů komentáře lze považovat lokální NSA za léčbu první linie pro pacienty s osteoartrózou, jak doporučuje britská agentura NICE. Autoři dokonce doporučují upřednostnit v první linii léčby topickou aplikaci NSA před systémovou z důvodu nižšího výskytu nežádoucích účinků léčby .
Nežádoucí účinky lokálních NSA
Nejčastěji hlášeným nežádoucím účinkem lokálních NSA jsou iritace kůže, která je závislá jak na použité aktivní látce, tak na vehikulu. Nejvíce reakci je zaznamenáno u ketoprofenu. V období 1996-2000 bylo zaznamenáno 770 těchto vedlejších účinků s četností výskytu 0,013/1000 až 0,028/1000 podle typu komerčního preparátu. Tři čtvrtiny byly zaznamenány v létě, polovina z nich byla uzavřena jako fotosenzitivita. Reakce byly hodnoceny jako závažně v asi 30% případů. Zkřížená reakce byla pozorována ve 23% případů, zejména mezi tiaprofenovou kyselinou, fenofibrátem, oxybenzonem a benzoylketonem. Další studie si všímala zkřížené senzitivitě ketoprofenu gelu a masti. Všichni pacienti vykazovali pozitivní test, velké procento pacientů však (11-67%) však mělo pozitivní reakci i na další látky. V klinické praxi je tedy třeba dbát zvýšené opatrnosti zejména v letním období u pacientů se známou polyvalentní alergií a užívajících tiaprofenovou kyselinu, fenofibrát, benzofenony nebo podobné látky (1). Nežádoucí účinky diclofenaku byly hlášeny vzácně. Nejčastěji se jednalo o lokální iritaci kůže, raritně při aplikaci na velké ploše. Systémovou reakce probíhaly v podobě nauzey, zvracení nebo bolestí v epigastriu.
Aplikační formy
Topická NSA leze používat v řadě aplikačních forem. Mezi nejoblibenější patří gely, masti, krémy, spreje nebo náplasti. Tyto aplikační formy obsahují obvykle podobné aktivní látky. Nejčastěji používanou látkou je diclofenak, ibuprofen, ketoprofen a nimesulid. Pro všechny aplikační formy platí obdobné aplikační doporučení.
Gely a krémy stejně jako ostatní lokální NSA jsou doporučovány pro pacienty s věkem nad 12 roků. Jsou indikovány u poranění měkkých tkání (poúrazové, záněty šlach, vazů, svalů) nebo lokalizovaných forem revmatismu a při degenerativních onemocněních. Doporučuje se opakovaná aplikace na postižené místo 2-4x denně. Aplikují se v množství 2-4 g a jemně se vtírají do kůže. Toto množství by například u Volatern emulgelu mělo vystačit na 400 – 800 cm² kožního povrchu. Délka léčby záleží na vyvolávající příčině a terapeutické odezvě. Obecně platí, že bez doporučení lékaře by se neměl gel aplikovat déle jak 2 týdny. Při selhání léčby by pacienti nejpozději po uplynutí této doby měly kontaktovat svého lékaře, v případě že se bolesti zhoršují, tak i dříve. Mezi kontraindikace použití patří hypersenzitivita na účinnou látku, astma, urtika. Zvýšené pozornosti by se mělo dbát u pacientů se známými nežádoucími učinky systémově podávaných NSA, zejména při ošetřování větších ploch. Gely se mohou aplikovat pouze na intaktní neiritovanou kůži. Data o používání NSA gelů v průběhu těhotenství nejsou známa, proto bychom jsme se jim měli raději vyhnout. Není známo, že by se lokální NSA vylučovaly do mléka při kojení. Gely mají spíše chladivý efekt, mohou však způsobovat vysušování kůže. Krémy mají schopnost kůži mírně promazávat, jejich prostupnost kůží však bývá menší než u masti. Masti se hůře roztírají, lépe však kůži promazávají a zajišťují účinné látce dobrou prostupnost.
Sprej
V České republice je dostupný i ketoprofen ve spreji. Jeho základní indikace a kontraindikace se neliší od ostatní topických NSA. Jeho použití se doporučuje u pacientů nad 15 roků, data pro mladší pacienty nejsou dostupná. Sprej se aplikuje na čistou neporušenou kůží, obvyklá dávka je 3-6 střiků 2-3 x denně. Maximální denní dávka je 18 střiků, což odpovídá 360mg ketoprofenu. Kontraindikací je vystavení sprejem ošetřených míst slunci a kontraindikace uvedení výše.
Náplasti
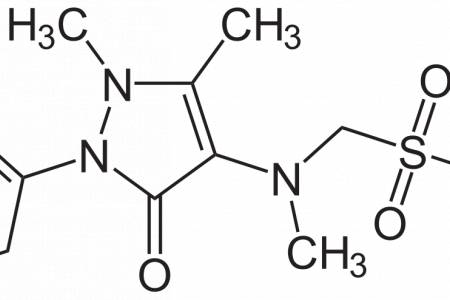
K dispozici máme i diclofenak v náplasťové formě. Náplast se aplikuje na bolestivé místo s neporušenou a neiritovanou kůži. Doporučuje se aplikace 1-2 x denně. V jednom balení nalezneme 10 náplastí velikosti 14x 10 cm. Každá náplast obsahuje 180 mg diclofenaku a pomocné látky želatinu, povidon 700, krystalizující sorbitol 70% a další.
Závěr:
NSA určená k lokální aplikaci jsou jednoznačným přínosem v léčbě bolestivých stavů vyvolaných degenerativním onemocněním nebo poraněním pohybového aparátu. Jejich role je často lékaři i pacienty podceňována a často jsou na jejich úkor upřednostňovány perorální formy NSA. Přitom lokální aplikační cesta vykazuje u řady onemocnění obdobný analgetický účinek a výrazně nižší riziko pro pacienta. Na našem trhu existuje řada účinných látek i aplikačních forem dle preferencí pacienta nebo lékaře. Nejčastěji používanou účinnou látkou je diclofenak, který přináší pacientům dobrý protibolestivý účinek a nízké riziko nežádoucích účinků.

 redakce
redakce